
水の異常性
1.通常の物質と異なり、液体から固体になると密度が小さくなる。
(∴氷が水に浮く)
2.液体としての密度は、4℃で最大となり、その前後で減少する。
4℃以上の温度では、通常の液体のように温度上昇とともに減少する。
3.水は温まりにくく、冷めにくい液体である。
(比熱が非常に大きい) 比熱=1cal/g
4.水は蒸発しにくい液体である。
<水を水蒸気に変えるには大きなエネルギ−を必要とする>
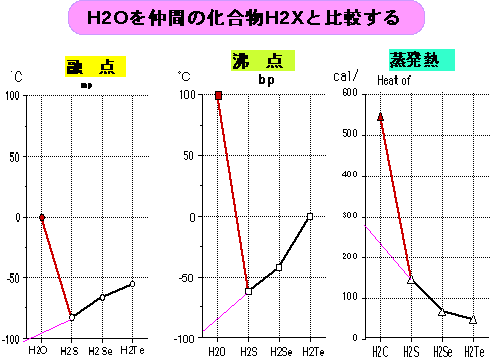
蒸発熱=540cal/g
5.水は簡単な分子構造のわりには沸点が高い。 沸点=100℃
周期表の仲間の中では異常に高い。
6.水の融点(氷点)は、簡単な分子構造のわりには高い。 氷点=0℃
常温で液体として存在する。
7.氷はなかなか融けにくい。
<氷を水に変えるのに大きなエネルギ−を必要とする>
融解熱=80cal/g
8.氷は圧力をかけると融点(氷点)が下がる。
<水の相図を見ると融点曲線が右下がり>。
通常の物質とは逆の傾向。
9.水は大きな溶解力をもつ。
身近に見られるの液体の大部分は水溶液である。
植物、動物の細胞、体液も水溶液。
10.水は非常に大きな表面張力(凝集力、毛管現象)をもつ(Hgに次ぐ)。
11.通常の生活条件下で液体、気体、固体の状態と状態変化をみることができる。
※ 水は大きな双極子モ−メントをもつ極性分子である。
水分子どうしには強い分子間力が働いている。
(分子間力:水素結合と双極子-双極子間引力)
その他
▲元(講義資料)へ戻る