|
酸・塩基の定義、pHの定義 |
-
水 は H2Oという安定した分子として存在しているが、ごく一部分 H+とOH-というイオンのかたちで存在している(図1)。
-
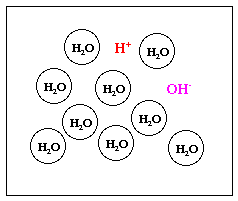
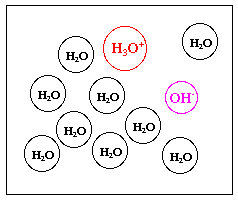
- 図1 水モデル1 図2 水モデル2
- 水がイオンに解離している反応を式で表すと、
- K
-
H2O
 H+ + OH-
H+ + OH-
- 25℃では[H+]=[OH- ]=1x10-7 mol/l と解離している割合はごくわずかである。
- すなわち、H2Oの濃度はほぼ一定とみなせるので、水の解離定数Kを
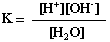 とすると、
とすると、 - K・[H2O]も一定の温度では一定値を示す。
- Kw= K・[H2O]と書き、水のイオン積という。 Kw=1x10-14 mol/lとなる。
- この水モデル1には一つ問題がある。H+は陽子そのもので、陽電荷が小さな核に集中したものであるので、水の中に安定に存在しているとは考え難いのだ。
- 実際には、H+はH2Oと結合し H3O+として存在していると考えられる。
- すなわち、水モデル2(図2)の方が実際の姿を表していると考えられる。
そこで、水のイオン解離反応式は、次のように書き改められる。
-
H2O + H2O
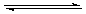 H3O+ + OH-
H3O+ + OH-
●pHの定義:
- 水の中のH+(水素イオン濃度)を次のように定義する。
pH=-log[H+]=-log[H3O+]
- 従って、水のpHは、
- -log[1x10-7]=7
- 例えば、0.1 および0.01mol/lのHClのpHは、それぞれ
- -log[0.1]=1, -log[0.01]=2
- となる。
- すなわち、pHが1大きいということは水素イオン濃度が1/10であるという意味である。
- pH > 7 の水溶液を酸性、pH < 7 の水溶液を塩基性という。
●酸: HA
+ H2O ![]() A-
+
H3O+
A-
+
H3O+
- 酸:水にH+を与える物質
[別の解釈]
- Kw
-
H2O + H2O
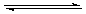 H3O+ + OH-
水は両性物質
H3O+ + OH-
水は両性物質 - 塩基 酸 Kw=[H3O+][OH- ]=1x10-14 mol/l
ここに酸HAを加えと、
- HA
+ OH-
+
H3O+
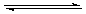 H2O + A- +
H3O+
H2O + A- +
H3O+
酸HAはOH- にH+を与える;その反応した分だけH3O+が残り、濃度を増す。pHが小さくなる。
●塩基: B
+ H2O ![]() BH
+ +
OH-
BH
+ +
OH-
- 塩基:水からH+を受け取る物質
[別の解釈]
-
H2O + H2O
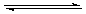 H3O+ + OH-
水は両性物質
H3O+ + OH-
水は両性物質
塩基 酸 Kw=[H3O+][OH- ]=1x10-14 mol/l
ここに塩基Bを加えると、
- B
+ OH-
+
H3O+
 O H-
+ BH
+ +
H2O
O H-
+ BH
+ +
H2O
塩基Bは H3O+からH+を受け取る;その反応した分だけOH- が残り、濃度を増す。pHが大きくなる。
*[別の解釈]では、酸、塩基の本質が水そのものにあるという根本理解に立つ。
水のイオン積 Kw=[H3O+][OH- ]=1x10-14 mol/lは、質量作用の法則から温度が一定でイオン濃度(厳密にはイオン強度)が大きくない時は水の中に酸や塩基が溶けていても一定である。そこで酸、塩基の一方の濃度が分かれば他方の濃度がすぐに求められる。
中和反応
HA + B --------> A- + BH+
例
HCl + NaOH --------> Na+ + Cl- + H-OH
NaOHは水の中でNa+ とOH- に解離している。BをOH- と考える。
中和によって生成する水のほかにできる物質を塩(salt)という。
- 【小用語辞典】
●「アルカリ性とは?」:指につけるとヌルヌルし、灰汁(あく)様の不快感があり、リトマスを青くし、酸と反応して塩となる性質。代表物質:NaOH, KOH。
●「塩基性とは?」:元々は水に溶けにくく(ヌルヌル感触を示さない)、酸と反応して塩をつくる性質に由来する。Fe(OH)2はアルカリ性を示さない。現代化学(ブレンステッドの酸塩基理論)では、塩基性の方が一般的に用いられる。
次のような可逆反応があるとする。
aA + bB + ……
 mM
+ nN + ……
mM
+ nN + ……この反応が平衡状態に達した時、温度が一定であればKは一定の値をしめす。これをを質量作用の法則という。
- Kを平衡定数という。
K = [ M]m・[ N]n…… /[A]a ・[B]b……
- 【小用語辞典】