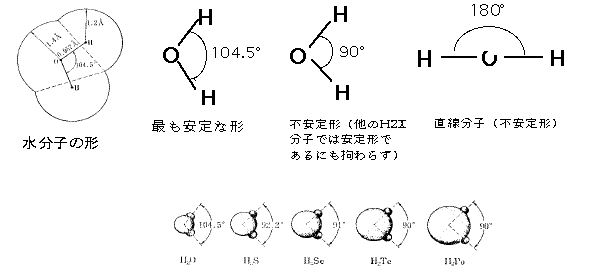
A.水の大きさ、かたち

水の結合角はなぜ104.5°なのか?
量子力学(電子の運動を取り扱う理論)が答えてくれる。
H2Oの電子状態の中で最も安定な形を理論的に求めると、
H-O間の結合距離が0.965Å、H-O-H間の角度が104.5°の場合であるという答えが出る。
電子状態は、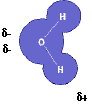
但し、dは部分的という意味d+:部分的に+電荷を帯びているという意味
このように分子内で電気的に+/-の偏りのある分子を「極性分子 (Polar molecule)」という。
極性分子間に働く引力
1. 双極子-双極子間引力
模式的にかくと、
双極子(dipole) : 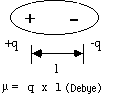
+ -の中心が離れている
m=q x l 双極子モーメント(m)単位: D(Debye)
q は電荷の大きさ、l は+/-間の距離
水の双極子モーメントは異常に大きい ( q の値が大きい)。
例えば、H2O: 1.94 , H2S: 1.02, CH3OH: 1.47
(もしも H2Oが直線分子であったならばm=0)
一般に、双極子モーメントをもつ分子は極性分子である。
(双極子モーメントは極性の大きさを示す尺度)
双極子間には大きな分子間力が働く:双極子-双極子間引力
方向性はない。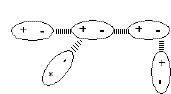
2. 水素結合
水分子が特定の方向に配列したときに大きな分子間力が生まれる。

:水素結合 (Hydrogen bond) 2 - 5 kcal/ mol
水素結合は双極子間引力の一種(方向性がある)
氷は、完全に方向性のある水素結合で水分子同士が結合している状態。この氷状態の方が分子間のすきま間が大きく、密度が小さい(1/11だけ)。
液体の水は、水素結合している分子と自由に位置を変えている分子の集合体。
通常の液体と同様に温度が下がるほど密度が大きくなるが, 4℃で最高となり,4℃から0℃に近づくと密度が小さくなる。理由:4℃から0℃の水は氷構造(水よりも密度の小さい)を持った部分を含むためである。
非極性分子間にも引力が働く
双極子モーメントが0の分子(非極性分子)も存在する。
例えば、ベンゼン、四塩化炭素のような対称構造をもつ分子
非極性分子間にも引力が働いていることは、液体、固体になる事から明らか
四塩化炭素 (CCl4) の bp=77℃ , mp = -22℃
ベンゼン(C6H6)の bp=80℃ , mp = 5℃
では、どんな分子間力か?
分子内に部分双極子が存在し,部分双極子間に引力が生じる
このような分子間力をvan der Waals引力という。
van der Waals引力は双極子間引力よりも弱い(約1/3)
※すでに学んだように全ての物質が(水素や球形のヘリウムですら)液体、固体になることを考えると、どんな分子間にも引力が働いていることがわかる。